Laut dem Jahresbericht der Europäischen Arzneimittel-Agentur (EMA) wurden im Jahr 2024 insgesamt 90 Empfehlungen für neue Anwendungsgebiete von bereits zugelassenen Arzneimitteln ausgesprochen. Zudem empfahl die EMA 46 Arzneimittel mit neuen Wirkstoffen zur Zulassung. Dies sind Wirkstoffe, die zuvor noch in keinem anderen Arzneimittel enthalten waren. Für ein Arzneimittel für neuartige Therapien (ATMP) wurde die Zulassung später zurückgezogen. Bis August 2025 sind von den verbleibenden 45 Wirkstoffen lediglich 31 Arzneimittel (rund 70 %) in Deutschland in Verkehr. Diese werden überwiegend in den Therapiegebieten der Onkologie und Hämatologie eingesetzt.
Bei den 14 nicht im Verkehr befindlichen Wirkstoffen handelt es sich vorwiegend um Impfstoffe, Diagnostika sowie Arzneimittel zur Prävention oder Behandlung von COVID-19. Allerdings sind auch einige Wirkstoffe aus der Onkologie, der Hämatologie sowie zur Behandlung der Alzheimer-Erkrankung bislang nicht eingeführt.
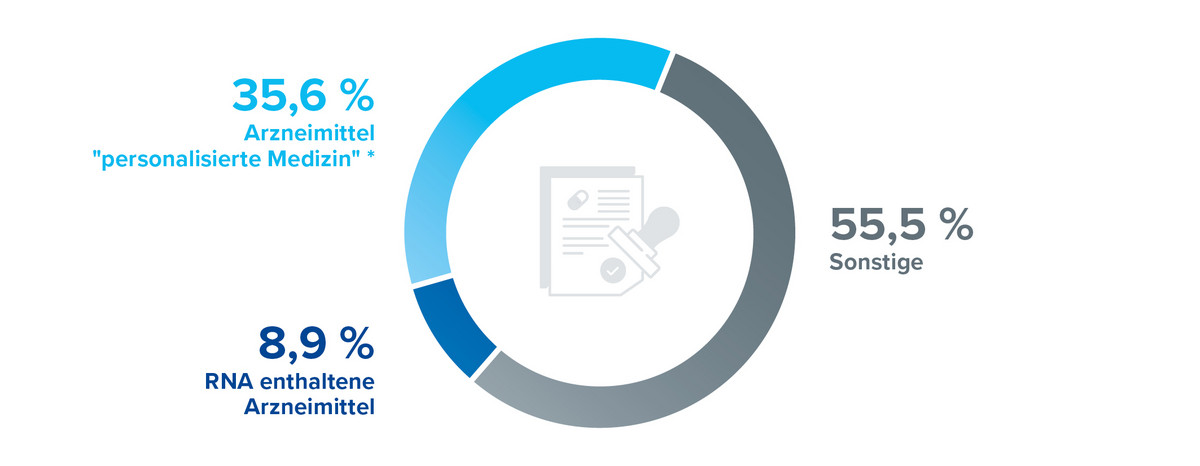
Vier der von der EMA im Jahr 2024 zur Zulassung empfohlenen Arzneimittel enthalten Ribonukleinsäure (RNA) als Wirkstoff – darunter zwei mRNA-Impfstoffe. Ein Impfstoff enthält erstmals eine neue Form der mRNA: selbst amplifizierende mRNA (sa-mRNA). Das bedeutet, dass die mRNA sich im Geimpften selbst vervielfachen kann. Die RNA-basierte Arzneimittelentwicklung hat insbesondere im Zuge der COVID-19-Pandemie erheblich an Dynamik gewonnen. Das Anwendungsspektrum dieser Wirkstoffklasse reicht jedoch weit über prophylaktische Impfstoffe hinaus. Bislang wurden acht RNA-Therapeutika primär zur Behandlung von Stoffwechselerkrankungen zugelassen, mittlerweile bestehen aber Forschungsaktivitäten diese Technologien auch für Indikationen wie Krebs, neurologische oder kardiovaskuläre Erkrankungen nutzbar zu machen.
Rund 35 % der im Jahr 2024 zur Zulassung empfohlenen Wirkstoffe wurden indikationsspezifisch nur in Verbindung mit dem Nachweis eines bestimmten Biomarkers oder genetischen Profils zugelassen. Diese Entwicklung unterstreicht den wachsenden Stellenwert personalisierter Therapieansätze. Durch die biomarkerbasierte Patientenselektion können Arzneimittel gezielter eingesetzt werden, wodurch sowohl klinische Wirksamkeit als auch Sicherheit optimiert werden kann. Dies ermöglicht eine individualisierte Versorgung, bei der therapeutische Entscheidungen zunehmend auf molekularbiologische Charakteristika der Erkrankung basieren.
Innovationen betreffen aber nicht nur die therapeutische Entwicklung, sondern zunehmend auch ökologische Aspekte pharmazeutischer Produkte. So hat die EMA im Juli 2025 erstmals eine Änderung an einem Arzneimittel befürwortet, bei der das bislang verwendete Treibgas durch eine umweltfreundlichere Alternative mit einem um den Faktor 1.000 reduzierten Treibhauspotenzial ersetzt wurde. Das Gas weist vergleichbare physikalisch-chemische Eigenschaften auf, und klinische Studien konnten belegen, dass die Sicherheits- und Wirksamkeitsprofile des neu formulierten Produkts mit der Wirkstoffkombination äquivalent zum bislang zugelassenen Arzneimittel sind.
Ein herausragendes Beispiel für die Entwicklung zielgerichteter und biomarkerbasierter Therapien ist die Behandlung des malignen Melanoms (schwarzer Hautkrebs). Pro Jahr erkranken in Deutschland etwa 22000 – 25 000 Personen daran. Das Erkrankungsrisiko steigt dabei mit höherem Lebensalter. Seit 2011 wurden in Deutschland elf neue Wirkstoffe zur Behandlung des Melanoms zugelassen, die zum Teil auf unterschiedliche molekulare Zielstrukturen bzw. Biomarkerprofile ausgerichtet sind: Binimetinib, Cobimetinib, Dabrafenib, Encorafenib, Ipilimumab, Nivolumab, Pembrolizumab, Talimogen laherparepvec, Tebentafusp, Trametinib und Vemurafenib. Einige dieser Wirkstoffe sind zudem noch für zahlreiche andere Krebsarten zugelassen.
Die deutlichsten Fortschritte zeigen sich im metastasierten Stadium des malignen Melanoms. Vor 2011 galt metastasiertes Melanom als nahezu therapieresistent; die mediane Überlebenszeit betrug unter Chemotherapie (Dacarbazin) oft weniger als ein Jahr. Entsprechend betrug die 5-Jahres-Überlebensrate in früheren deutschen Registern nur etwa 15 % (Zentralregister Malignes Melanom der Deutschen Dermatologischen Gesellschaft: Untersuchungen zur Metastasierung des malignen Melanoms. 2011). Mittlerweile zeigen die Daten für die neuen Wirkstoffe 5-Jahres-Überlebensraten bis zu 36 % bei Patientinnen und Patienten mit metastasiertem Melanom (Eisemann et al.; Longer survival from melanoma in Germany. Dtsch Arztebl Int., 2024). Das bedeutet, dass sich das Mortalitätsrisiko in diesem Krankheitsstadium mehr als halbiert hat.
Aktuell befindet sich mit der tumor-infiltrierende Lymphozyten – Therapie (TIL-Therapie ) ein weiteres innovatives Therapiekonzept im Zulassungsverfahren. Dabei handelt es sich um eine Form der adaptiven Zelltherapie, bei der autologe, nicht genetisch modifizierte Lymphozyten aus dem Tumorgewebe isoliert, ex vivo expandiert und anschließend dem Patienten erneut infundiert werden. Ziel ist es, die körpereigene Immunantwort gegen die Tumorzellen gezielt zu verstärken. Das auf diesem Therapieprinzip basierende Arzneimittel Lifileucel gehört im Übrigen zu den ersten beiden Therapien, die im Rahmen des EU-HTA-Verfahrens einer gemeinsamen europäischen Nutzenbewertung unterzogen werden.